
تتفاعل محاليل الاحماض مع محاليل القواعد لتعطي ملح وماء ويعرف هذا التفاعل بأسم تفاعل التعادل
تفاعل التعادل : هو تفاعل حمض مع قاعده بحيث ينتج ماء وملح .
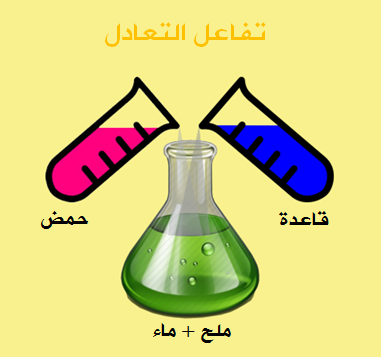
حمض + قاعده ← ملح + ماء
تمتاز هذه التفاعلات بأن قيمة PH للمحلول الناتج يساوي (7 ) اي ان المحلول متعادل.
وبالتالي فأن تركيز ايون الهيدروجين +H يساوي تركيز ايون الهيدروكسيد -OH.
حالات تفاعلات التعادل :-
- حمض مع قاعده .
- حمض شاذ مع قاعده .
- حمض مع قاعده شاذه : ويعتبر هذا التفاعل مميزا لانه ينتج غاز ثاني اكسيد الكربون مما يدلل على وجوده في القاعده .
طريقة حل مثل هذه التفاعلات :-
- نفكك المعادله الى ايونات حسب قاعدة XY او حسب التوزيع الذري للعنصر.
- نكون الماء H2O ,والذي ينتج من تفاعل من ايون +H وايون -OH.
- الايونات الاخرى هي التي تشكل صيغة الملح الكيميائيه . ( يجب الانتباه الى شحنات الايونات المكونه لصيغة الملح ) .

ليست هناك تعليقات:
إرسال تعليق