يمكنك الرجوع الى قائمة المراجع التي تم الاستعانه بها لانشاء مدونه
للاطلاع على المراجع اضغط هنا
↘
تهدف هذه المدونة إلى تقديم وحدة دراسية لطلبة الصف التاسع حول موضوع الحموض والقواعد حيث ستتعرف في هذه الوحدة على مفهومي الحمض والقاعدة، والفرق بينهما، وكيف يمكن الكشف عن كل منهما باستخدام ما يعرف بالكواشف، ومن خلال قيم درجة الحموضة ستتعرف على طريقة تمييز كل من الحموض والقواعد القوية عن الحموض والقواعد الضعيفة، كما ستتعرف على تفاعلات الحموض والقواعد، وتحضير الحموض والقواعد صناعياً.

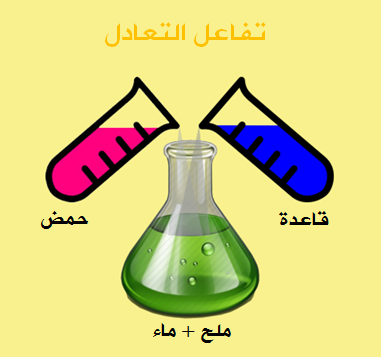
الصفات العامه الكيميائيه
|
الحموض
|
القواعد
|
الايون المشترك الناتج عن تأينها
|
||
لون كاشف تباع الشمس
|
||
تأثيرها على الجلد
|
||
قيمة الرقم الهيدروجيني لمحاليلها
|





لون المحلول
|
الكاشف
| ||
القاعدي
|
الحمضي
|
المتعادل
| |
أزرق
|
وردي
|
بنفسجي
|
دوار الشمس
|
أحمر
|
عديم اللون
|
عديم اللون
|
الفينو لفثالين
|
أصفر
|
وردي
|
أحمر
|
الميثيل البرتقالي
|
القواعد
|
مجالات استخدامها
|
هيدروكسيد الصوديوم
|
يدخل في صناعة الصابون ، ومواد تنظيف
المصارف
|
الامونيا ( النشادر )
|
يدخل في صناعة مواد التنظيف ، والاسمده
|
هيدروكسيد المغنيسيوم
|
يدخل في صناعة الادويه التي تعالج الحموضه
الزائده في المعده
|
هيدروكسيد الكالسيوم (الجير المطفأ )
|
يستخدم في البناء ، وطلاء سيقان الاشجار،
وتنقية مياه الشرب من الشوائب
|
